生化学はアミノ酸、タンパク質などの生体高分子に関わる酵素活性や代謝回路などを研究する生物分野である。近年では、in vivo あるいは in vitro の実験を分子動力学シミュレーションで予測するといったバイオインフォマティクス的な手法も取り入れられている。
補因子 (cofactor)
タンパク質からなる酵素と可逆的に結合し、酵素反応を進行させる非タンパク質性の分子である。補因子は単独では酵素として機能せず、タンパク質からなる酵素と結合して初めて酵素として機能する。このとき、タンパク質から酵素をアポ酵素と呼び、アポ酵素と補因子の複合体をホロ酵素と呼ぶ。
補因子が低分子量の有機化合物からなる場合は、これを補酵素(coenzyme)と呼ぶ。キノンやビタミンなどが様々な反応系において補酵素として働く。また、補因子が金属イオンなどである場合は金属イオン補因子と呼ぶ。銅イオン、鉄イオン、マンガンイオンなどがある。
ホロ酵素 (holoenzyme)
タンパク質から酵素は、それ単独で酵素活性を示すものと示さないものがある。単独で酵素活性を示さない酵素をアポ酵素という。アポ酵素は、補因子と呼ばれる非タンパク質性の低分子量有機化合物や金属イオンなどと複合体を形成して、初じめて酵素活性を示す。このとき、アポ酵素と補因子の複合体をホロ酵素という。
アポ酵素 (apoenzyme)
タンパク質から酵素は、それ単独で酵素活性を示すものと示さないものがある。単独で酵素活性を示さない酵素をアポ酵素という。アポ酵素は、補因子と呼ばれる非タンパク質性の低分子量有機化合物や金属イオンなどと複合体を形成して、初じめて酵素活性を示す。
モチーフ (motif)
α ヘリックスや β シートなどの二次構造の組み合わせにより構成される構造である。超二次構造ともいう。タンパク質の三次構造から特徴的に見出すことができる。例えば、次の 2 タンパク質はともに β 構造により構成されている β バレルと呼ばれるモチーフを持つ。

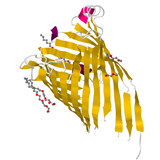
その他に、βαβ モチーフ、Zn フィンガーモチーフ、ヘアピン β モチーフ等がある。
ドメイン (domain)
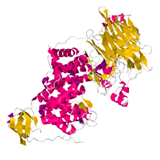
タンパク質の三次構造において、コンパクトに折りたたまれ部分。他の部分とは、独立に進化する。例えば、左に示したタンパク質は CATH 分類では、3 つのドメインを持つタンパク質として分類されている。実際の三次構造を見ても、おおよそ 3 つの塊が見える。
ジスルフィド結合 (disulfide bond)
2 つのシステイン残基の間で形成される共有結合である。タンパク質分子の三次構造の安定化に寄与する。大腸菌生体内では DsbA や DsbB と呼ばれる酵素がユビキノンと共同して、ジスルフィド結合を形成する。