植物が冠水ストレスを受ける際に示す生理反応に関して、A. thaliana や Oryza などの種を用いてよく研究なされている。植物を冠水させると、植物にとって外部環境が著しく変化する。例えば、水中の溶解度が低いために酸素と二酸化炭素の利用が制限されたり、植物体にエチレンガスが蓄積されたりする。また、土壌中の各種の金属イオン(マンガンイオン、鉄(II)イオン、硫化水素や他の硫化物イオンなど)に変化が生じたりする。
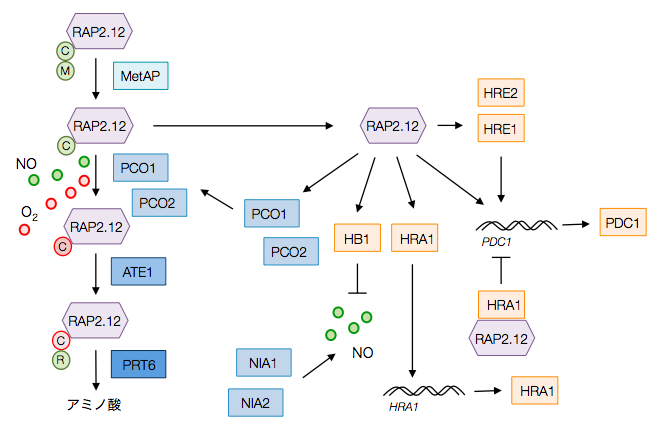
エネルギーの面からみると、植物が冠水される環境あるいは酸素濃度が著しく低い環境に置かれると、ATP を生産を継続するために嫌気呼吸を中心に行うようになる。そのため、低酸素条件下に置かれた植物は RAP2.12 などの転写因子の調節を受けて、PDC1 や ADH1 などの解糖系の遺伝子の発現量が増える。RAP2.12 や RAP2.2 の N 末端にあるシステインは有酸素条件では、PCO1, PCO2 などに酸化されて、プロテアソームに分解される。しかし、低酸素条件に置かれると、RAP2.12 などは分解されずに核内に入り、低酸素ストレス応答遺伝子の発現を促進する。
RAP2.12 のように好気条件において N 末端の修飾を受けて分解されるパスウェイは N 末端則経路と呼ばれている。N 末端則経路は RAP2.12 が属する第 7 グループのエチレン応答因子(ERF-VII)に共通して見られる。とくに高等植物ではよく保存されている。植物のライフサイクルにおいて個々の組織が何らかの原因で低酸素ストレスにさらされるために、よく保存されているのではないかと推測される。
植物が冠水されるとエネルギー代謝関連の遺伝子が変動する他に、エチレン応答、アブシジン酸応答やジベレリン応答なども始まる。これらは植物の伸長成長や細胞死を促進する。伸長成長により、植物組織は早く水面にでることが可能になる。また、根の皮層細胞の細胞死と崩壊の誘導は、死んだ細胞の空間を通って酸素が通れるようになる通気組織の形成に役立つ。
| RAP2.2 |
Ethylene-responsive transcription factor RAP2-2
冠水ストレス耐性を持つイネの SUB1A 遺伝子と同じサブファミリーである。RAP2.2 は植物の根では常に高発現しているのに対して、地上部での発現量は低い。RAP2.2 の発現はエチレン分子あるいはエチレン応答パスウェイによって調節されている。CTR1 欠損株では RAP2.2 の発現量が増え、EIN2 欠損株では RAP2.2 の発現量が低下していることがわかっている。また、低酸素環境において、RAP2.2 の過剰発現は ADH1 および PDC1 の発現を促進し、ACS9 の発現を抑制する。RAP2.2 は低酸素ストレス(冠水ストレス)に対して耐性を持ち、RAP2.2 欠損株では低酸素ストレス環境において正常に成長できない。
|
| RAP2.12 |
ethylene-responsive transcription factor RAP2-12
冠水ストレスや低酸素ストレスに応答する転写因子と考えられる。RAP2.2 のホモログである。RAP2.12 は常に発現しているが、有酸素の環境下において Acyl-CoA binding protein (ACBP) と結合して細胞内に局在化している。低酸素環境になると、RAP2.12 は ACBP から遊離し、核内に入り低酸素応答遺伝子の転写を促進すると考えられる。
|
| PCO1 |
plant cysteine oxydase 1
好気条件において PCO は RAP2.2 および RAP2.12 などの ERF-VII 転写因子のシステインの酸化を行い、これらの転写因子の分解を促進する。PCO を欠損させた場合、好気条件においても低酸素ストレス応答遺伝子の発現が促進される。一方で、PCO1 または PCO2 のどちらかを過剰発現させると、低酸素ストレス応答遺伝子の発現が抑制され、冠水耐性が弱くなる。PCO1 および PCO2 のほかに、PCO3, PCO4 および PCO5 も知られているが、PCO3, PCO4 および PCO5 の発現量は PCO1 および PCO2 に比べ著しく低い。PCO 過剰発現させると、好気条件においても植物の成長が遅くなる。
|
| HRE1 |
hypoxia responsive ethylene responsive factor 1
HRE1 は低酸素ストレスに応答する転写因子である。HRE1 を過剰発現させた場合、植物は嫌気に対して耐性が強くなることが確認されている。HRE1 が嫌気条件下において PDC1 や ADH1 などの発現を促進するが、好気条件では促進しない。逆に、HRE1 および HRE2 の両方を欠損させた場合は低酸素ストレスへの耐性が弱くなる。HRE1 と HRE2 は低酸素条件により発現調節を受けるが、両者は異なるメカニズムで合成される。HRE1 はタンパク質合成により調節されるが、HRE2 は転写後修飾により発現調節される。
|
| ATE1 | arginyltransferase 1 |
| PRT1 |
proteolysis 1
N 末端則経路において、タンパク質の末端がフェニルアラニン、チロシン、およびトリプトファン残基のものを分解する酵素である。
|
| PRT6 |
proteolysis 6
N 末端則経路において、タンパク質の末端がアラニン残基のものを分解する酵素である。
|
| HB1 | hemoglobin 1
|
| PDC1 | pyruvate decarboxylase 1
PDC1 は解糖系においてピルビン酸をアセトアルデヒドに変換する酵素である。植物は低酸素の環境に置かれると嫌気呼吸が優位になるため、PDC1 や ADH などの遺伝子の発現量が高くなる。PDC 遺伝子ファミリーには PDC1, PDC2, PDC3, および PDC4 が存在する。PDC1 は主に根組織、PDC2 は主に葉組織で発現し、PDC3 は若い組織や根などで発現する。PDC1 および PDC2 の両方が低酸素耐性を示し、両者を欠損すると、冠水ストレス耐性が弱くなる。
|
| ADH1 | alcohol dehydrogenase 1
解糖系において PDC の働きにより生成されたアセトアルデヒドは ADH1 などのアルコール脱水素酵素の働きによってエタノールに代謝される。ADH1 は PDC 遺伝子ファミリーと同様に、低酸素ストレス化で発現量が高くなり、低酸素ストレス耐性を強くする。
|
| HRA1 |
hypoxia response attenuator 1
|
| SUS1 | sucrose synthase 1
植物は光合成から得られたグルコースをシンク組織に運ぶ際に、グルコースをショ糖に変換してから運ぶ。このようなショ糖を分解あるいは合成する酵素して SUS などが知られている。SUS は低酸素条件において発現量が上昇し、解糖系に炭素源を供給していると考えられる。A. thaliana では SUS1 および SUS4 が常時発現されているが、低酸素環境あるいは冠水環境に置かれると発現量が上昇する。しかし、SUS1 および SUS4 変異株を用いた実験では、低酸素環境において、野生株とほぼ変わらないことが確認された。このことにより、低酸素条件下におけるスクロース代謝パスウェイにおいて、SUS1 および SUS4 は優先ルートでないことがいえる。そのほかに SUS2, SUS3, SUS5 および SUS6 が知られているが、これらはの発現量は非常に低い。
|
| LBD41 | lob domain protein |
| HUP7 | hypoxia-responsive unknown protein HUP7 |
| HUP9 | hypoxia-responsive unknown protein HUP9 |
| CER1; CER22 |
eceriferum 1
CER1 はエピクチクラワックスの生合成に作用する。エピクチクラワックスが表皮組織を覆うことで、表皮組織から水分損失が抑えられる。植物の乾燥耐性を強化する。CER22 は以前 CER1 と異なる遺伝子と考えられたが、現在では CER22 が CER1 と同一遺伝子であることがわかっている。
|